来源:科学大院
它是一种激素,也是治疗贫血的神奇药物,它成就了生物技术的独角兽Amgen,也击溃了环法七冠王,就在四天前,它又带来了诺奖。
 (图片来源:veer图库)
(图片来源:veer图库)2019年诺贝尔生理学或医学奖的三位得主William G。 Kaelin, Jr。、Gregg L。 Semenza和Sir Peter J。 Ratcliffe早在2016年就以细胞对低氧感知与适应机制的研究斩获了诺奖风向标——拉斯克基础医学奖,所以也没有让人特别意外。三人发现和鉴定的关键分子低氧诱导因子1 (hypoxia-inducible factor 1, HIF-1)一时间也在朋友圈爆红。今天我们希望回到这一项研究的起点——促红细胞生成素(erythropoietin,缩写EPO),一个神奇的分子。
它,是红细胞生成的最重要因素
红细胞是血液中数量最多的一种血细胞,是脊椎动物体内通过血液运送氧气和二氧化碳的最主要媒介。红细胞在骨髓中生成:造血干细胞首先增殖分化为各类血细胞的祖细胞,其中红系祖细胞能够进一步分化成熟为红细胞。正常情况下人类的红细胞生成速率很低,但在出血、溶血以及缺氧等胁迫压力下,红细胞的生成速率甚至可以提高8倍。在这一过程中,促红细胞生成素EPO是最重要的因素,没有之一。
EPO是一种主要在肾脏合成的激素,化学本质是一种有高度糖基化修饰的蛋白质。为什么是在肾脏?每分钟有1升左右的血液流经肾脏,所以肾脏能够快速有效地监测到血液中氧含量的变化。当血液中氧含量较低时,肾脏就会快速响应,大量合成EPO。后者通过血液循环进入骨髓,促进其中的红系祖细胞向红细胞的转变。成熟的红细胞从骨髓中被释放到循环系统,以提高机体对氧气结合能力。肾脏感受到血液中氧气浓度增加后会减少EPO的合成,进而降低骨髓中的红细胞含量。
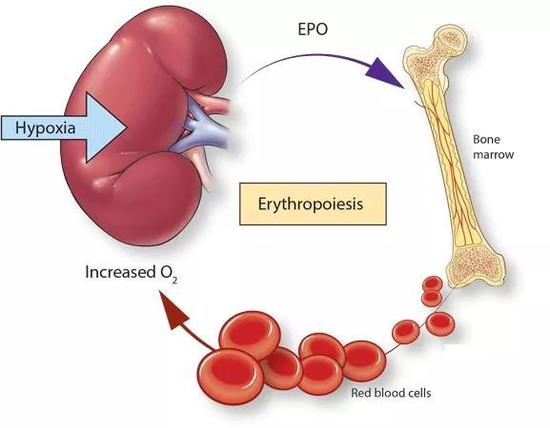 EPO调节红细胞生成示意图
EPO调节红细胞生成示意图这就构成了一个完美的调节闭环。而高原生活的人以及一些贫血患者常常碰到血氧含量持续低的状况,就无法完成上述循环,刺激肾脏持续分泌EPO,使其血液中的EPO浓度高于常人。
花了近80年才揭开它的真面目
和很多重大发现类似,科学家对EPO的认识不是一帆风顺的,一路伴随着质疑、挑战。从EPO概念的提出到最终确定具体的分子花了接近80年的时间。
1906年,法国科学家Carnot 和Deflandre给正常的兔子输注了贫血兔子的血清后,发现正常兔子血浆里红细胞计数增加,他们认为血浆中某种体液因子能够刺激调节红细胞的生成。这就是最早的EPO概念原型。遗憾的是随后几十年里研究者并没有成功重复这一实验结果,一个的主要原因是当时对新生红细胞的计数定量并不精准。
1950年Reissmann和Ruhenstroth-Bauer的异种共生实验给出了真正有力的证据。他们通过外科手术将两只活体大鼠的循环系统连接在一起,将其中一只置于低氧环境,另一只呼吸正常的空气,结果两只老鼠的体内都大量生成了红细胞。毫无疑问,血液循环系统中存在一种能够刺激红细胞生成的激素,促红细胞生成素EPO由此得名。另一方面也说明EPO对低氧非常敏感。
EPO究竟是一个什么分子?美国科学家Goldwasser用了30年的时间,最终在生物化学水平阐明了这个问题。工欲善其事,必先利其器。EPO的功能是能刺激新生红细胞,但后者的计数定量并不精准。红细胞里最主要的功能分子是含有血红素的血红蛋白,血红素分子中心含有一个亚铁离子,所以Goldwasser研究组用放射性的铁同位素标记新生的红细胞,建立了灵敏检测EPO活力的方法,使得从动物体液样本分离纯化浓度极低的EPO(每毫升纳克级)变得可能。但EPO的分离还是异常艰难的,他们的研究对象从肾脏换成贫血绵羊血浆、转向因钩虫感染而严重缺铁的病人尿液,最后在1977年从2550升日本再生障碍性贫血患者的尿液中纯化得到8毫克的人EPO蛋白。
1985年,人源EPO的蛋白质测序以及基因克隆得以完成。EPO基因编码了一段193个氨基残基的多肽,在分泌过程中剪切掉信号肽后成为166个氨基酸残基组成的成熟蛋白质,含有4个发生糖基化修饰的位点。1998年,EPO核磁共振溶液结构以及EPO及其受体复合物晶体结构得到解析。至此,人们对EPO才有了最直观的认识。
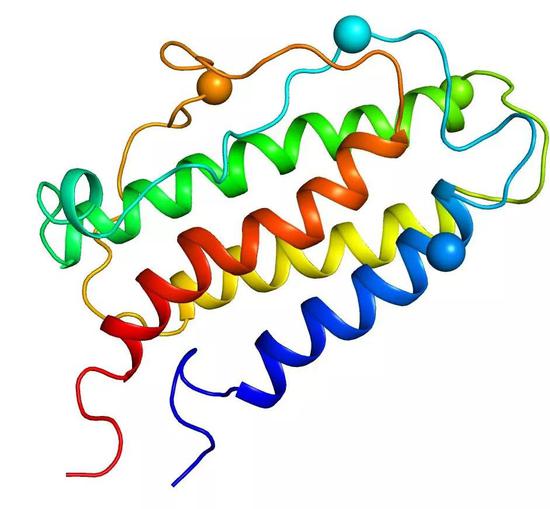 EPO的三维结构(PDB code:1BUY, PYMOL 软件出图),球状标示为糖基化位点
EPO的三维结构(PDB code:1BUY, PYMOL 软件出图),球状标示为糖基化位点它,催生了制药巨头
在此之前,治疗贫血一般需要通过输血补充红细胞的不足。随着人们对EPO的认识不断深入,通过注射EPO刺激自身骨髓的红细胞生成让问题变得更加简单。但像Goldwasser那样直接从体液纯化EPO非常困难,产量也很低。而EPO蛋白质和基因序列的测定,使得大量生产重组人源EPO成为可能。
完成这一创举的是一家叫做Applied Molecular Genetics(Amgen,安进)的生物技术公司。Amgen成立于1980年,一开始只有7名成员,他们希望用当时兴起的分子生物学技术实现生物制药,在他们目标的清单上有干扰素、生长激素释放因子、乙肝疫苗、表皮生长因子这些火热的名字,然而这些尝试无一成功。直到1985年,来自中国台湾的华人科学家林福坤克隆了人EPO的基因,进而利用DNA重组技术实现了人工合成的EPO生产。
重组人源EPO和人体内源的EPO蛋白质一级序列相同,也具有类似的糖基化修饰,自然也具有内源EPO的活力。1989年6月Amgen的第一个产品重组人红细胞生成素Epogen获得美国FDA批准,用于治疗慢性肾功能衰竭引起的贫血和HIV感染治疗的贫血。Epogen销售额短短的三个月之内就突破了1600万美元。随后的20年里,Amgen在重组人源EPO市场里始终处于统治地位。仅2010年Epogen就给Amgen带来了高达25亿美元的收入。2018年,Amgen的股票市值1288亿美元,位列全球制药巨头第八位。
值得一提的是,Amgen一开始正是同Goldwasser合作,由Goldwasser提供纯化的人EPO蛋白进行测序,但很快Goldwasser和Amgen因理念不合而分道扬镳。而从事基础研究的Goldwasser及其所在的芝加哥大学从来都没有想过为他发现的这种激素申请专利,所以没有因为EPO商业上巨大的成功获得一分钱。
它,怎么就成了兴奋剂
在我们呼吸过程中,氧气进入细胞的线粒体驱动呼吸链,同时大量产生ATP,这是我们身体里能量的主要来源。贫血的人体内缺乏足够的健康红细胞,最直接的影响是吸收的氧气不足,令人觉得乏力,类似长跑力竭时呼吸不畅的感觉。注射重组人源EPO后,贫血患者的机体能产生更多的红细胞,运载更多的氧气,伴随着更多能量分子ATP的产生,有效地缓解了症状。
然而某些体育竞技工作者也开始动重组人源EPO的歪脑筋了,如果用EPO类型人工重组激素刺激运动员体内产生更多的红细胞,就有可能提高运动员获取氧气和产生能量分子的能力,也就能够提高运动员在自行车、长跑、越野滑雪等耐力项目中的成绩。1980年《应用生理学》一篇论文表示,血液兴奋剂(促红细胞生成素、人工氧载体和血液回输等)可以使人体耐力增加34%。若运动员使用EPO,他们在跑步机上跑8公里的时间将比之前缩短44秒。事实上,自行车和马拉松一直都是EPO类兴奋剂的重灾区。1998年环法自行车赛期间,西班牙费斯蒂纳车队的一名队医在法国边境被捕,她竟然随身携带了400瓶人工重组EPO药物!结果当然是整支车队被踢出了环法并禁赛。
1992年巴塞罗那奥运会上,国际奥委会就把EPO列为了违禁药物名单,但是,重组人源EPO检测非常困难,在2000年奥运会之前甚至没有方法能有效地检测出运动员是否使用。原因有几种:1)人体液中EPO含量极低,正常人每毫升血液中EPO约为130-230纳克;2)人工重组EPO与人体内源EPO蛋白质氨基酸组成完全一样,仅仅是糖基化形式有非常细微的不同;3)EPO在血液中的半衰期仅为5-6小时,一般在最后一次注射的4-7天后就检测不到;4)EPO水平的个体差异性大,很难设立绝对的定量标准。
2000年开始,世界反兴奋剂机把尿检作为直接检测重组EPO唯一科学的验证方法。由于人工重组EPO与人体内源EPO糖基化形式的些微差别,两种分子的带电性质有非常小的不同,能用一种名为“等电聚焦”的电泳方法区分开,这是直接法检测人工重组EPO的主要策略。但是,某些用人来源细胞表达的重组EPO就没有糖基化差别,所以也有专家建议用碳同位素含量的不同区分外源EPO和内源EPO。
 EPO是耐力性项目选手经常使用的违禁药物(图片来源:http://sportsscientists.com/wp-content/uploads/2013/02/EPO.jpg)
EPO是耐力性项目选手经常使用的违禁药物(图片来源:http://sportsscientists.com/wp-content/uploads/2013/02/EPO.jpg)其实,目前不同的EPO检测方法都还存在局限,比如美国自行车传奇人物兰斯·阿姆斯特朗自己承认在7次夺冠的环法自行车赛中都服用了EPO及其他兴奋剂药物,但他实际没有在当时任何一次兴奋剂测试中被真正确认为EPO阳性。到底是“道高一尺”还是“魔高一丈”,我们还要拭目以待。
它,如何成就诺奖
最后聊两句EPO和2019年诺贝尔生理学或医学奖间的联系。
EPO是人体感受并响应低氧最典型的案例,所以Semenza和Ratcliffe这两位诺奖得主不约而同选择以EPO入手研究细胞对低氧感知与适应机制,第一步就是寻找EPO基因能够响应氧气变化的元件。Semenza在编码EPO蛋白的基因序列下游3’端找到一段256个碱基关键的非编码序列,命名为低氧应答元件(hypoxia response element)。如果突变或删除这段元件序列,EPO蛋白就对低氧的响应能力大大下降。如果把这段元件序列融合到其他与其他与低氧无关的基因下游3’端,这些改造后的基因在低氧条件下也出现了类似EPO的激活。
随后Ratcliffe课题组发现,这一低氧应答元件并不只存在于负责生成EPO的肾脏或者肝脏细胞中,在其他更多的细胞类型中,都能在低氧条件下发挥作用。换句话说,这种对低氧的响应可能并不是EPO所专有的,而是细胞中更广泛存在的一种现象。这些不负责生成EPO的其他细胞中必定含有某些分子(比如负责开启基因表达的转录因子)能够感受到氧气浓度的变化,结合到低氧应答元件上开启EPO等基因的表达。
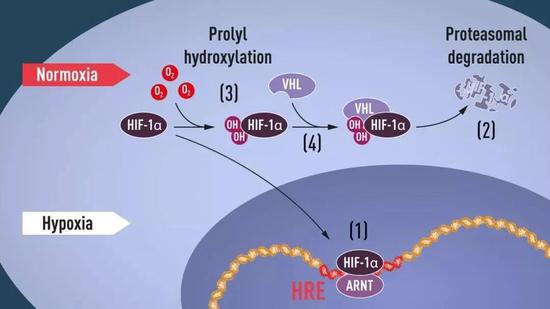 细胞响应低氧的分子机制。正常氧气条件下,低氧诱导因子HIF-1α被修饰反应添上了两个羟基(-OH),就能够被VHL识别并打上了“待分解”标签,从而被蛋白酶体分解。低氧情况下HIF-1α的羟基化反应无法发生不会被降解能在细胞中稳定存在,和ARNT组合成缺氧诱导因子HIF,能结合到特定的低氧应答元件(HRE),开启EPO类似基因的表达。(图片来源:https://www.nobelprize.org/)
细胞响应低氧的分子机制。正常氧气条件下,低氧诱导因子HIF-1α被修饰反应添上了两个羟基(-OH),就能够被VHL识别并打上了“待分解”标签,从而被蛋白酶体分解。低氧情况下HIF-1α的羟基化反应无法发生不会被降解能在细胞中稳定存在,和ARNT组合成缺氧诱导因子HIF,能结合到特定的低氧应答元件(HRE),开启EPO类似基因的表达。(图片来源:https://www.nobelprize.org/)而低氧应答元件的发现,也为找到这类转录因子提供了工具。Semenz课题组的王广良博士用EPO基因的低氧应答元件作铒,在几百升细胞裂解液中钓到了一个叫低氧诱导因子1(hypoxia-inducible factor 1, HIF-1)。最终HIF-1被证实正是响应低氧上调EPO基因的转录因子,但它并不仅仅只负责调控EPO基基因的表达,它的下游至少有几百个基因,广泛地参与包括肿瘤生成在内的生物学进程。在近期的诺奖解读文章中已有很多的介绍,这里就不赘述了。

 2019-10-11
2019-10-11












